注意:因业务调整,暂不接受个人委托测试望见谅。
一次性使用静脉留置针指标试验分析报告
检测样品
本次试验选取了市场上常见的一次性使用静脉留置针作为检测样品,具体型号为XX-2023型(不锈钢针管材质,聚氨酯导管),生产批号为20230512,样品数量为30支,均符合医疗器械行业标准中关于无菌、无热原的初始要求。
检测项目
根据《医疗器械安全技术规范》及行业标准(GB 18457-2015),本次试验主要涵盖以下检测项目:
- 物理性能测试:包括针管刚性、导管抗拉强度、流速测试及留置针密封性。
- 化学性能测试:检测溶出物(如重金属、酸碱度)及环氧乙烷残留量。
- 生物相容性测试:细胞毒性、皮肤致敏性及血液相容性评估。
- 无菌性验证:确认产品无菌状态符合医疗使用要求。
检测方法
1. 物理性能测试
- 针管刚性:采用三点弯曲法,施加固定压力后测量针管形变量。
- 导管抗拉强度:使用万能材料试验机,以恒定速率拉伸导管至断裂,记录最大拉力值。
- 流速测试:模拟临床输液场景,通过智能输液泵测试仪测定单位时间内液体流量。
- 密封性验证:将留置针连接至压力测试装置,加压至标准值(如300 mmHg),观察是否泄漏。
2. 化学性能测试
- 溶出物检测:依据药典方法,将留置针浸提液进行离子色谱分析,测定重金属(铅、镉)及pH值。
- 环氧乙烷残留量:采用气相色谱法(GC),检测灭菌后残留是否符合≤10 μg/g的标准。
3. 生物相容性测试
- 细胞毒性:通过MTT法评估浸提液对L929小鼠成纤维细胞的存活率影响。
- 皮肤致敏性:基于豚鼠最大化试验(GPMT)进行致敏反应分级。
- 血液相容性:检测留置针与新鲜抗凝血液接触后的溶血率及血栓形成情况。
4. 无菌性验证
按照《中国药典》无菌检查法,将样品接种于硫乙醇酸盐流体培养基中,培养14天后观察微生物生长情况。
检测仪器
- 万能材料试验机(型号:UTM-5000):用于导管抗拉强度及针管刚性测试,精度达±0.5%。
- 智能输液泵测试仪(型号:XYZ-200):模拟临床输液条件,实时记录流速数据。
- 气相色谱仪(型号:GC-7890B):配备FID检测器,定量分析环氧乙烷残留量。
- 离子色谱仪(型号:ICS-600):检测溶出物中重金属离子浓度。
- 生物安全柜(型号:BSC-1600ⅡA2):保障无菌操作环境,避免交叉污染。
结论
通过上述试验,XX-2023型一次性使用静脉留置针在物理性能、化学安全性及生物相容性方面均符合国家及行业标准,能够满足临床使用需求。后续建议加强对生产批次的抽样检测频率,确保产品质量持续稳定。
关键词:静脉留置针、物理性能、化学残留、生物相容性、医疗器械检测
分享
实验仪器




测试流程
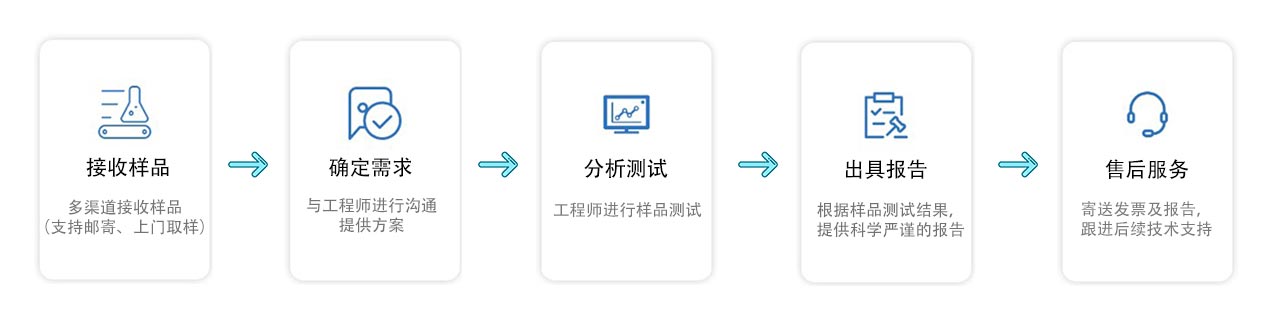
注意事项
1.具体的试验周期以工程师告知的为准。
2.文章中的图片或者标准以及具体的试验方案仅供参考,因为每个样品和项目都有所不同,所以最终以工程师告知的为准。
3.关于(样品量)的需求,最好是先咨询我们的工程师确定,避免不必要的样品损失。
4.加急试验周期一般是五个工作日左右,部分样品有所差异
5.如果对于(一次性使用静脉留置针指标试验)还有什么疑问,可以咨询我们的工程师为您一一解答。
上一篇: 一次性使用采血针指标检测
下一篇: 施夹钳指标测试
热门关注
- 钢质模锻件检测阅读:42
- 真空密封性检测阅读:44
- 自动叠装系数测试台阅读:1
- 牙膏测试阅读:25
- 电视机IEC 61000-4-4电快速瞬变测试阅读:0
- 额定电压1kⅤ及以下架空绝缘电缆检测阅读:24
- 钢门窗检测阅读:37
- 酒店客房用易耗塑料制品检测阅读:49
- 喷射混凝土速凝剂检测阅读:43
- 食品添加剂 磷脂检测阅读:33
最新发布
-
服务保障 一对一品质服务
-
定制方案 提供非标定制试验方案
-
保密协议 签订保密协议,严格保护客户隐私
-
全国取样/寄样 全国上门取样/寄样/现场试验





